Предупреждение клеточной гибели при остеоартрите
Остеоартрит – дегенеративное заболевание суставов, приводящее к потере их функции. Заболевание начинается в 20 – 30 лет, развивается постепенно, яркая клиническая картина наблюдается после 40. В пожилом возрасте патология разной степени тяжести наблюдается у 70 % населения.
Содержание
- Что такое остеоартрит
- Факторы, приводящие к остеоартриту
- Классификация и симптомы
- Коксартроз
- Плечевой остеоартрит
- Локтевой остеоартрит
- Остеоартрит голеностопного сочленения
- Остеоартрит кистей рук
- Остеоартрит (остеоартроз)
- Симптомы остеоартрита
- Диагностика остеоартрита
- Лечение остеоартрита
- Остеоартрит
- Предотвращение развития остеоартрита
- Предупреждение клеточной гибели при остеоартрите
Что такое остеоартрит
Для лучшего понимания патогенеза, коротко о строении сустава: это сочленение двух или нескольких костей, покрытых тонким хрящом, служащим амортизатором при движении. Полость сустава (синовий) содержит внутрисуставную жидкость, обеспечивающую снижение трения при движении. Сочленение покрыто оболочкой из соединительной ткани (капсулой). Движение и прочность обеспечивает мышечно-связочный аппарат.
В развитии заболевания играет роль изнашивание суставов, вызванное физиологическими причинами под действием провоцирующих факторов и иммунные механизмы.
Изнашивание суставов ведет к снижению эластичности хрящевой ткани. Клетки, вырабатывающие нормальный коллаген, отмирают. Оставшиеся хондроциты производят атипичный коллаген, не способный поддерживать упругость. На поверхности хряща образуются вдавления, затем трещины. Постепенно хрящ истончается настолько, что при соприкосновении суставных поверхностей возникает острая боль, человек не может передвигаться. Болезненность усиливается при растяжении связок и сухожилий, вовлекающихся в процесс, а также при попадании в синовиальную жидкость обломков хряща (детритов). Подвижность сустава ограничивается.
У молодых людей синтез и распад хрящевых клеток – хондроцитов сбалансирован. В ответ на провоцирующие факторы катаболизм (распад) тут же компенсируется анаболизмом (синтезом новых клеток). С возрастом катаболизм начинает преобладать, что ведет к дегенеративным процессам, охватывающим сустав и прилегающие ткани.
По краям сустава на месте хрящевой разрастается костная ткань, образующая выросты – остеофиты. Сустав теряет форму, деформируется. Отсюда еще одно название заболевания – деформирующий остеоартроз.
ВНИМАНИЕ! Лечение суставов дорогими пустышками: ревматологи 12 лет обманывали пациентов по всей стране. Подробнее>>
Иммунные механизмы запускаются под воздействием провоцирующих факторов, характеризуются патологическим иммунным ответом – выработкой антител к собственным клеткам. Аутоиммунное происхождение имеет эрозивный вид остеоартрита.
Факторы, приводящие к остеоартриту
Дегенеративные изменения в хряще обусловлены:
- физиологическими процессами старения;
- избыточный вес, вызванный нарушением обмена веществ, малоподвижным образом жизни, отечными синдромами разной этиологии (гормональной, почечной, сердечной);
- травматизацией сустава, вызванной несчастным случаем или особенностями профессии (артрит колена у футболистов, локтевого и плечевого сустава у работающих длительное время с отбойным молотком, эпикондилит локтевого сустава у гольфистов и теннисистов);
- наследственной предрасположенностью (генетический дефект генов, кодирующих синтез коллагена хряща);
- неправильным питанием с преобладанием жиров и углеводов, употреблением некачественной воды;
- врожденной повышенной подвижностью сустава;
- инфекциями;
- системными аутоиммунными заболеваниями соединительной ткани;
- эндокринными болезнями;
- чрезмерными физическими нагрузками;
- переохлаждением, особенно в сочетании с повышенной влажностью;
- вредными привычками (злоупотребление алкоголем, курение).
Классификация и симптомы
По происхождению остеоартрит бывает первичным и вторичным, возникающим после травм или на фоне других заболеваний.
Локализованный – коленного сустава (гонартроз), тазобедренного (коксартроз), плечевого, локтевого, кистей, стоп, позвоночника (спондилез);
Генерализованный – остеоартрит разных групп сочленений.
- боль, усиливающаяся при движении, уменьшающаяся в покое;
- «стартовая» скованность, проходящая через 15 – 20 мин;
- хруст, щелчки при движениях;
- отечность, сопровождающаяся краснотой, гипертермией;
- уменьшение амплитуды движений до полного обездвиживания;
- деформация, видимая невооруженным глазом;
- костные выросты (узлы) в сочленениях кисти.
По статистке, охватывает 34 % случаев от общего числа артритов. Заболевание протекает в несколько стадий:
- Человек испытывает незначительные кратковременные боли после неловкого движения.
- Больной чувствует нарастающую усталость в ногах после долгой ходьбы, подъема тяжестей. Начинаются деструктивные процессы в хряще.
- Хрящ истончается, амортизация не осуществляется, трение поверхностей сочленения вызывает болезненность. Ввиду отсутствия нервных окончаний в хряще, боль не такая интенсивная. При вовлечении костной ткани, имеющей нервные окончания, болевой синдром ярко выражен.
- Формируются остеофиты. Дегенеративный процесс распространяется на мышцы и сухожилия. Появляется отечность, сгибание — разгибание ноги происходит с трудом. Во время ходьбы возникает острая боль с хрустом, в силу чего двигательная активность ограничивается.
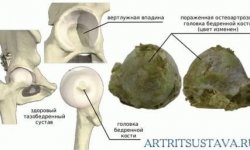
Коксартроз
Самый распространенный вид остеоартрита (42 % случаев). Начинается с ощущения дискомфорта в паховой области по утрам. Чувствуется скованность и болезненность после поднятия тяжестей, длительной прогулки. Дискомфорт быстро проходит.
Постепенно алгия распространяется на бедро, область колена, носит ноющий характер. В состоянии покоя уменьшается. После длительной прогулки появляется хромота. Далее в процесс вовлекается мышечно-связочный аппарат бедра.
При выраженной деформации конечность укорачивается, хромота постоянная. Деструкция охватывает область ТБС и прилежащие ткани.
Плечевой остеоартрит
По статистике, более 16 % жителей Земного шара страдает этим видом заболевания. Развернутая клиническая картина представлена болезненностью, хрустом, ограниченностью движений в области плеча и ключицы. Больной с трудом поднимает руку, не в состоянии расчесаться. В далеко зашедших случаях артралгия постоянна. Больной не может спать ночью, прикоснуться к суставу. Даже малейшее движение вызывает артралгию. Сочленение распухает, краснеет, деформируется.
Локтевой остеоартрит
Характерны «скрежет» и «заедание» в зоне локтя. Первый симптом вызван трением поверхностей сочленения вследствие потери эластичности, истончения хряща. Второй – ограничением движения вследствие попадания детритов в межсуставное пространство.
На поздних стадиях процесс распространяется по ходу локтевого нерва на дистальные отделы конечности: больной ощущает онемение пальцев (безымянного и мизинца). Увеличенный в размере сустав (вследствие скопления синовиальной жидкости и отечности) давит на нервные окончания, вызывая ощущение покалывания. Сустав перестает разгибаться (флексия), в силу чего давление на локтевой нерв усиливается, возникает «туннельный синдром», обусловленный длительным сдавлением нерва в месте его расположения – мышечно-фиброзном туннеле. Боли усиливаются в холодную погоду.
Остеоартрит голеностопного сочленения
Самая распространенная причина инвалидности в США. Болезнь имеет несколько степеней.
1 степень. Незначительные кратковременные болевые ощущения во время длительной ходьбы, занятий спортом и физических нагрузок, которые быстро проходят. Изменения на РГ не видны.
2 степень. Артралгия постоянная, как во время движения, так и в покое, ноющая, усиливается после сна при попытке встать на ноги (стартовая боль). Сустав отечен, гиперемирован, горячий на ощупь. Выраженные изменения на РГ.
3 степень. Суставные изменения видны невооруженным глазом, конечность в зажата в одном положении. Характерный симптом – невозможность ступить на ноги. На РГ – признаки дегенеративного процесса.
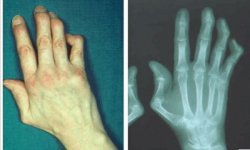
Остеоартрит кистей рук
Другое название – «Узелковый остеоартроз». Подвержены женщины старше 45 лет. Помимо упомянутых этиологических факторов, играют роль особенности профессии, связанные с однообразными движениями пальцев – секретарша, ткачиха. Во время дебюта заболевания женщина не испытывает сильных болей. Постепенно в области кистей формируются характерные узелки – утолщения костной ткани
Узелки Бушара располагаются на тыльной стороне кисти, поражают проксимальные межфаланговые сочленения. Узелки безболезненные на ощупь, могут приводить к ограничению подвижности суставов.
Узелки Гебердена локализуются на дистальных межфаланговых сочленениях среднего и указательного пальцев. Реже на других пальцах кисти. Женщины климактерического возраста испытывают сильную боль.
Образование узелков может продолжаться до 5 лет, эпизодически проявляясь дискомфортом. К завершению формирования узелков видны ярко выраженные дегенеративные суставные изменения.
Остеоартрит (остеоартроз)
17 августа 2011
Остеоартрит (деформирующий остеоартроз) — является наиболее распространенным видом артрита, и представляет собой хроническое заболевание, поражающий сустав, суставной хрящ, суставную сумку, кости, мышцы и связки. При этом хрящ твердеет, теряет свою эластичность, в результате чего он разрушается, а скольжение суставных поверхностей ухудшается. Хрящи могут истончаться, что приводит к нарушению их амортизационных функций во время ударов.
Заболевание чаще всего развивается на крупных суставах человеческого организма — коленных, тазобедренных, суставах позвоночника и мелких суставах кистей рук, особенно на больших пальцах. Во время болезни сустав может деформироваться.
Остеоартриту подвержены мужчины и женщины, причем тазобедренные суставы чаще поражаются у мужчин, а кистевые и коленные – у женщин. Это заболевание прогрессирует с годами и может привести к потере работоспособности.
Болезнь обычно проявляется в двух формах. Наиболее распространен первичный остеоартрит, который развивается после 45 лет и неуклонно прогрессирует с годами. Первичный артрит поражает в первую очередь тазобедренные и коленные суставы. Причинами его выступают чрезмерные нагрузки на суставы.
Вторичный остеоартрит чаще всего поражает молодых людей, имеющих повторяющиеся травмы или повреждения суставов, а также инфицирование сустава, врожденный порок суставов, нарушения обмена веществ, ожирение.
Остеоартрит развивается в результате того, что в хрящевой ткани нарушается обмен веществ, что приводит к постепенному ее разрушению. В результате первоначального повреждения сустава начинается разрушение хряща. Он теряет эластичность, на нем образуются микротрещины, которые приводят к отделению хрящевых фрагментов, вплоть до полного разрушения хряща. Это может привести к тому, что кости могут начать соприкасаться друг с другом при ходьбе.
К причинам развития остеоартрита медики также относят:
- возраст, т.к. с возрастом хрящ имеет тенденцию к потере эластичности;
- избыточный вес, который способствует ускорению процесса разрушения хряща;
- повреждение хряща чрезмерными нагрузками, а именно – травмы, переломы, вывихи, растяжение связочного аппарата сустава, а также постоянные микротравмы сустава – вывихи, подвывихи, например, у профессиональных спортсменов и у представителей определенных профессий;
- интоксикация организма, т.к. алкоголь, курение, вирусные инфекции приводят к тому, что токсины накапливаются в хрящевой ткани;
- сосудистые нарушения – атеросклероз. Например, если стенки артерии, питающей головку и сустав тазобедренной кости, поражены атеросклерозом, то это приводит к нарушению питания головки и развитию остеоартроза;
- эндокринные нарушения – сахарный диабет, гипотиреоз, климактерический период;
- варикозное расширение вен голени, что приводит к венозному застою и гипоксии тканей, что способствует нарушению обменных процессов в суставах;
- наследственная слабость хряща, в результате чего некоторые формы остеоартрита проявляются в семьях.
Симптомы остеоартрита
Основным симптомом остеоартрита является боль в пораженном суставе, которая усиливается при ходьбе. Сначала боль появляется периодически, после нагрузок, и исчезает в состоянии покоя, но если заболевание не лечить, то боль становится постоянной, даже при минимальной активности. Больные характеризуют это боль как «ноющую».
Если остеоартритом поражены коленные суставы, то боль возникает при сгибании колена, например, при спуске с лестницы. При остеоартрите тазобедренных суставов чаще всего наблюдается боль в бедре, но также могут беспокоить и болезненные ощущения в паху, ягодицах.
Первичный остеоартрит позвоночника вызывает боль в шее и в области поясницы. Интенсивность боли может меняться в зависимости от изменений погоды и атмосферного давления. Со временем это все может привести к уменьшению подвижности сустава, скованности движений, может возникнуть и «блокада сустава», когда кусочки хряща попадают между поверхностями сустава, что сопровождается резкой болью и ограничением движения. Часто наблюдается и крепиция в суставах – хруст и треск могут беспокоить при движении, причиной чего является трение суставных поверхностей костей.
Могут также наблюдаться такие симптомы остеоартрита как скованность суставов и усиление боли при их сгибе, длящиеся обычно до 15 минут, особенно после периода неподвижности, например, по утрам после сна, долгого сидения, или после периода повышенной активности. Облегчение наступает после физической разминки.
Также сустав может изменить внешний вид – увеличиться в объеме, может наблюдаться повышение температуры сустава, его покраснение. В суставах может скапливаться жидкость из-за постоянного раздражения синовиальной оболочки (внутреннего слоя суставной сумки).
Одним и сложнейших осложнений остеоартрита является появление костных выростов в суставах кистей, чаще встречающееся у женщин в возрасте после 40 лет. Эти выросты могут быть болезненными, а могут не сопровождаться болезненными ощущениями, и тогда люди продолжают вести активный образ жизни.
Часто вторичный остеоартрит может протекать бессимптомно, даже тогда, когда рентген показывает изменения сустава.
Диагностика остеоартрита
Диагноз может ставиться на основании данных опроса и осмотра пациента, а также результатах лабораторных исследований. Кроме того, больному обычно назначают рентгенографию и ультразвуковое исследование сустава.
Доктор будет интересоваться повреждениями, которые вызвали симптомы остеоартрита в суставе, об образе жизни. Осмотр будет направлен на внимательное изучение внешнего вида беспокоящих суставов.
Также назначается рентгенологическое исследование суставов, т.к. с его помощью можно увидеть изменения, сопровождающие остеоартрит, например, краевые разрастания кости, сужение суставной щели. Рентген показывает, насколько серьезно повреждены суставы. Для оценки толщины суставного хряща, состояния суставной сумки и тканей возле сустава и выявления в них воспаления, проводится ультразвуковое исследование суставов. Как дополнительная диагностика остеоартрита, для подтверждения диагноза, могут проводиться артроцентез – пункция сустава, или же магнитно-резонансная томография.
Специальных лабораторных исследований для выявления остеоартрита не существует. Из-за отсутствия воспалительных изменений, анализ крови проводится обычно для того, чтоб исключить другие формы артрита, например, ревматоидный артрит, подагра.
Лечение остеоартрита
В основе лечения остеоартрита лежат мероприятия по защите суставов от воздействия факторов, которые способствуют прогрессированию заболевания. К сожалению, в настоящее время пока не существует лекарств, которые могли бы восстановить суставной хрящ.
Целями лечения являются:
- уменьшение боли в суставе;
- улучшение функционирования сустава, увеличение его подвижности;
- уменьшения рисков прогрессирования заболевания;
- работа с больным для того, чтоб он научился справляться с заболеванием, избегать длительного стояния на ногах, длительной ходьбы, подъема и переноса тяжестей, занятий спортом, способствующих повышенным нагрузкам на суставы.
Целью медикаментозной терапии является устранение симптомов болезни, а именно: уменьшение болезненных ощущений в суставах и улучшение состояния хрящевой ткани. Для снижения боли врачи назначают обезболивающие препараты и нестероидные противовоспалительные средства.
Если боли сильные то назначают диклофенак (диклонат). При их применении нужно быть осторожными, так как эти лекарства обладают побочными эффектами, например, длительный прием парацетамола может привести к повышению артериального давления. Нестероидные противовоспалительные средства отрицательно действуют на желудочно-кишечный тракт, и могут привести к воспалению слизистой оболочки желудка, к развитию язвы желудка, нарушению функций почек. Для улучшения кровоснабжения элементов сустава также назначаются сосудистые препараты, например, агапурин, трентал, ксантинола никотинат.
На начальной стадии остеоартрита применяются также препараты, способствующие улучшению состояния хряща – хондропротекторы, например, хондроитина сульфат и глюкозамина сульфат, диацереин, гиалуроновая кислота. При их постоянном приеме, у больных может наблюдаться улучшение подвижности суставов, т.к. в организм вводится материал для восстановления хряща. Эти препараты действуют медленно, поэтому принимать их нужно длительно.
Для улучшения скольжения в суставе и для снятия воспаления, врач может назначать и внутрисуставное введение глюкокортикоида, кеналога, дипроспана, раствора гиалуроната натрия. Одновременно вводятся обезболивающие лекарства – например, лидокаин. Этот метод лечения действует очень быстро, что приводит к тому, что больные начинают активно его применять, однако этот метод не лечит заболевание, а лишь убирает симптомы остеоартрита. Также частое применение этого метода может привести к повреждениям хряща и костей. Поэтому часто использовать этот метод нельзя.
При высокой степени поражения сустава, которое сопровождается резким ограничением подвижности, при выраженном болевом синдроме, который не поддается медикаментозному лечению, назначают эндопротезирование суставов – замена сустава механическим протезом. Чаще всего эта операция проводится на тазобедренных и коленных суставах. После этой операции больной может увеличить свою физическую активность. Также может проводиться артропластика – пластическая операция на суставе для восстановления или исправление функций сустава, путем замены поверхностей сустава искусственными материалами.
При вторичном остеоартрите назначается также санитарно-курортное лечение остеоартрита. В санатории можно проводить комплексную реабилитацию, в которую входят лечебные грязи, физиотерапевтические процедуры, лечебная физкультура, ванны, массаж. К физиотерапевтическим процедурам относятся ультрафиолетовое облучение, электрофорез, переменные магнитные поля. Полезны также различные тепловые процедуры, аппликации озокерита, торфяной и иловой грязей. Благоприятное воздействие оказывают лечебные ванны, а именно морские, сульфидные и йодобромные.
Для укрепления мышц вокруг суставов применяют электростимуляцию. Позитивно влияют на течение болезни постоянное пребывание на свежем воздухе и отсутствие стрессовых ситуаций. Однако такое лечение показано вне периодов обострения заболевания.
Очень важно при этом изменить свой стиль жизни, регулировать массу тела и обязательно давать себе физические нагрузки. Специальные физические упражнения помогут сформировать вокруг сустава крепкий мышечный корсет и достаточное кровообращение во всей конечности. В домашних условиях перед занятиями спортом можно прикладывать к больному суставу грелку или специальную согревающую лампу. Очень важно не переохлаждать суставы.
Остеоартрит
Предотвращение развития остеоартрита
Любой человек может выполнять несложные действия, которые помогут предотвратить развитие остеоартрита. Тому, кто страдает данным заболеванием, наши советы помогут предотвратить прогрессирование остеоартрита.
Исследования показывают, что даже незначительное уменьшение массы тела в комбинации с физическими упражнениями помогают снимать боль и восстанавливать подвижность суставов намного эффективнее, чем каждый метод отдельно.
Молодые люди, у которых случались серьезные травмы коленей, находятся в группе повышенного риска развития остеоартрита в будущем. Предотвращение травм возможно при условии использования соответствующего спортивного оборудования, а также при занятиях спортом в безопасных условиях. Если у подростка случается серьезная травма колена, ему следует в дальнейшем использовать бандаж для того, чтобы стабилизировать коленный сустав, а также снизить нагрузку на коленные суставы.
Физиотерапевт или тренер по атлетике порекомендует, как вернуться к активному образу жизни после травмы.
Остеоартрит: физические упражнения
Проконсультируйтесь с врачом перед тем, как начинать занятия спортом.
Какие упражнения особенно полезны при остеоартрите?
Перечислим упражнения, которые особо полезны пациентам с остеоартритом:
Упражнения, которые не рекомендуются при остеоартрите
Если руки пациента поражены остеоартритом, ему следует избегать тех упражнений, которые предполагают нагрузку на кисти и пальцы (например, езда на велосипеде). При остеоартрите ног следует избегать больших нагрузок на коленные суставы, например, при игре в теннис.
Также следует избегать чрезмерных нагрузок в общем. Боль в суставах, которая продолжается более 2-х часов после упражнений, — признак того, что Вы перетрудились. Исследования показывают, что увеличение нагрузки вовсе не означает лучшего результата и физического состояния после занятий. Потому следует заниматься в пределах индивидуальной нормы. Если какое-либо упражнение вызывает боль, попробуйте другое. Если боль появляется во время упражнений, попробуйте следующее:
Почему физические упражнения так важны при остеоартрите?
Регулярные упражнения необходимы для того, чтобы поддерживать подвижность и предотвращать слабость мускулов и суставов. Упражнения также помогают поддерживать нормальный вес тела, что крайне важно для суставов. Лишний вес повышает нагрузку на суставы, что, в свою очередь, приводит к прогрессированию заболевания.
Отсутствие регулярных упражнений не только ослабит мускулы, но и позволит остеоартриту прогрессировать быстрее. Упражнения не приведут к изнашиванию поврежденного сустава. Однако последние исследования показывают, что при неплотном суставе некоторые упражнения могут быть противопоказаны. Лечащий врач поможет определить, какие именно упражнения рекомендуются в конкретном случае.
Упражнения на растяжку помогут избавиться от неподвижности суставов, а также предотвратить травмы. Полезны также упражнения, направленные на укрепление мускулов и хрящей, которые помогут укрепить весь сустав.
В ходе нескольких исследований ученые установили, почему физические упражнения так важны для людей, страдающих остеоартритом:
Упражнения: правильная мотивация
Не смотря на осознание значения физических упражнений, многим из нас тяжело заставить себя заняться спортом. Причины тому могут быть совершенно разными. Мы подскажем, как мотивировать правильно себя.
Упражнения: рекомендации для тех, кто страдает остеоартритом
Тем людям, которые страдают остеоартритом, определенные физические упражнения помогают снять боль и неподвижность суставов. Среди таких упражнений:
Аэробика, которая помогает укрепить сердце и легкие, а также повысить выносливость организма:
Примечание: начинайте с небольших нагрузок. Например, выполняйте упражнения по 5 минут несколько раз в день. Затем постепенно увеличивайте время, пока не будете заниматься по пол часа в день.
Силовые упражнения помогают укрепить мускулы:
Примечание: перед тем, как выполнять силовые упражнения, следует определить, какие именно упражнения подходят именно Вам. Для этого следует проконсультироваться с врачом, тренером физиотерапевтом. Специалист подскажет, как правильно выполнять данные упражнения.
Упражнения, направленные на растяжку, при помощи которых можно улучшить подвижность суставов, а также предотвратить их повреждение.
Примечание: упражнения на растяжку помогают улучшить осанку и равновесие, что помогает предотвратить падения.
Упражнения, которые рекомендуются при остеоартрите коленей:
Если у Вас остеоартрит коленных суставов, Вы можете попробовать носить специальную обувь, смягчающую удары, а также стельки, позволяющие перераспределить вес и снизить нагрузку на суставы. Наколенники, закрепленные на коленях в определенном положении, также помогают ослабить боль.
Проконсультируйтесь с врачом, который подскажет оптимальные для Вас упражнения. Также спросите у врача:
Некоторые виды физиотерапии помогают снять боль, например, воздействие на суставы высокой или низкой температурой:
Низкая температура помогает снять боль – приложите к суставу лед или замороженные овощи, обернутые в полотенце.
Среди других методов физиотерапии, снимающих боль в суставах, — подкожная электростимуляция нервов и ультразвук.
Постарайтесь продолжить занятия после того, как боль утихнет, поскольку физические упражнения крайне важны для поддержания подвижности и укрепления суставов людей, страдающих остеоартритом.
Предупреждение клеточной гибели при остеоартрите
На сегодняшний день заболевания суставов различной локализации являются одной из наиболее частых причин обращения к врачу. Данная категория заболеваний по праву может считаться социально значимой, так как поражает значительную часть населения и приводит к развитию стойкого болевого синдрома, чаще всего обусловленного синовиитом. Наиболее распространенной патологией, сопровождающейся поражением суставов, является деформирующий остеоартроз (ДОА), у лиц пожилого возраста его частота составляет 97 %. В структуре заболеваемости хроническими заболеваниями суставов первое место занимает ревматоидный артрит (РА), приводящий к инвалидизации уже через 3–5 лет после начала заболевания. Для ДОА и РА характерен болевой синдром и синовиит, значительно более выраженный в клинической картине РА, что и обусловливает многолетние хронические боли. Социально-экономические последствия заболеваемости РА обусловлены тем, что поражаются лица трудоспособного возраста, и качество жизни (КЖ) больных снижается весьма значительно [7, 37, 49]. Итак, говоря о РА и ДОА, мы не можем не выделить общность течения, которая проявляется, прежде всего, воспалением, болью (одним из ведущих механизмов формирования болевого синдрома является воспалительный процесс) и значительным снижением КЖ [15, 29]. При этих заболеваниях большая роль в патогенезе в частности в детерминации воспалительного процесса отводится цитокинам (ЦК) [5, 31].
РА – это аутоиммунное ревматическое заболевание неясной этиологии, характеризующееся хроническим эрозивным артритом, поражением внутренних органов для которого характерно волнообразное течение с чередованием периодов высокой и низкой активности [27]. В современных научных источниках РА называют аутоиммунным хроническим воспалительным заболеванием с преимущественным поражением синовиальных соединений, и основой патогенеза которого является цитокиновый дисбаланс [48].
Состояние цитокинового профиля больных РА, с одной стороны, характеризуется избыточной продукцией интерлейкина-1, -6 (ИЛ-1, ИЛ-6), фактора некроза опухоли-α (ФНО-α), что проявляется синовиальным воспалением и в отдаленной перспективе деструкцией хряща и кости, а с другой, синергичным ингибированием интерлейкинов-4, -10 (ИЛ-4, ИЛ-10). Необходимо отметить, что концентрации цитокинов могут варьировать в зависимости от фазы заболевания. Так, рост уровня ИЛ-6, ИЛ-10 и ФНО-α характерен для хронического течения РА [8, 9]. ИЛ-1β является одним из наиболее важных медиаторов воспаления при РА. Отмечают значительное увеличение его продукции в синовиальной ткани, с последующим ростом концентрации в синовиальной жидкости и сыворотке крови, коррелирующей с активностью заболевания, что стимулирует выход нейтрофилов из костного мозга, рост и дифференцировку лимфоцитов, участие в запуске ассоциированного с синовиальным воспалением неоангиогенеза, активацию макрофагов и индукцию синтеза многих других ЦК, хемокинов, матриксных металлопротеиназ и ферментов, способствующих деструкции хряща и костной ткани [14, 26]. В своей работе Авдеева А.С. и соавт. (2015) отмечают факт взаимосвязи показателей цитокиновых сетей с такими факторами, как активность заболевания, уровнем аутоантител и степенью деформации суставов у пациентов. Высокий уровень ИЛ-6 и хемокина IP-10 отмечался в группе пациентов с высокой активностью патологического процесса. В группе пациентов со значением уровня IgG более 45 МЕ/мл таких цитокинов как ИЛ-1β, ИЛ-2, ИЛ-6, ИЛ-12, ИЛ-15, интерферон-γ (ИФН-γ), ФНО-α, а также хемокинов, и, наконец, в группе пациентов с эрозивным поражением суставов была отмечена положительная корреляционная связь количества эрозий с уровнем ИЛ-1β (r=0,3; p=004) и васкулоэндотелиального фактора роста (ВЭФР) (r=0,4; p=0,007) [1]. Феофанова Е. В. и соавт. (2013) отмечают, что ВЭФР может быть использован как информативный критерий при оценке активности воспалительного процесса при РА [34]. В оценке степени активности воспаления также, по мнению Пачкуновой М.В. и соавт. (2014), большое значение имеет ФНО-α – при наблюдении уровня ЦК (ИФН-γ, ФНО-α) у группы из 80 пациентов были отмечены достаточно высокие значения, что позволяет утверждать их важное клиническое (нарастание концентрации ФНО-α характеризуется увеличением риска возникновения внесуставных проявлений болезни и обусловливает большую активность воспалительного процесса, а увеличение концентрации ИФН-γ достоверно связано с активностью воспалительного процесса и продолжительностью заболевания более 1 года и приводит к снижению КЖ и функционального статуса больных) и прогностическое значение (перспективы использования в качестве дополнительных лабораторных тестов для диагностики РА и оценки активности воспалительного процесса) [28]. В дополнение к работе Пачкуновой М.В. и соавт. можно привести исследование, проведенное NakajimaA. и соавт. (2016). Были проанализированы уровни экспрессии мРНК ИФН-γ, ФНО-α и ИЛ-17 и корреляционные взаимодействия между этими цитокинами (попарно), производилось сравнение уровней экспрессии цитокинов как у пациентов, получавших ингибиторы ФНО-α, так и у тех, кто получал обычные противоревматические лекарственные средства. Уровни экспрессии ФНО-α коррелировали с ИФН-γ, а также наблюдались отрицательные корреляционные связи между парами цитокинов – ФНО-α и ИЛ-17, ИЛ-17 и ИФН-γ. В данном случае понимание характера выработки этих цитокинов может быть полезно в отдаленной перспективе при цитокиновом целевом лечении РА биологическими противоревматическими лекарственными средствами [46].
На данный момент этиология РА неизвестна, но существуют предположения о важной роли экзогенных (инфекционные и неинфекционные) и эндогенных факторов (цитрулиновые белки и пептиды). Роль экзогенных факторов в данном контексте можно охарактеризовать, как вторичную, так как степень их участия зависит от генетической предрасположенности [11]. Тем не менее нельзя отрицать важное патогенетическое значение инфекционных агентов. Говоря об экзогенных инфекционных факторах развития РА, необходимо упомянуть исследование уровня цитокинов у пациентов с РА, ассоциированным с Chlamydiatrachomatis, опубликованное Рябцевой Т.В. и соавт. в 2014 году. Цитокиновый профиль у данных больных демонстрировал высокие значения ИЛ-6 и низкие ИЛ-2 и характеризовался Th2-направленностью. Также определяли уровень ИЛ-6 и ИЛ-2 в группе пациентов, у которых C. trachomatis выявлена на данный момент не была, но встречалась в анамнезе, значения ИЛ-6 и ИЛ-2 в этой группе превышали таковые в группе с РА и C. trachomatis [30]. Арлеевская М.И. и соавт. (2013) отмечают, что высокий уровень сывороточных цитокинов в период отсутствия клинико-лабораторных признаков может быть одним из патогенетических факторов развития раннего РА, а стимуляция их продукции, возможно, опосредована частыми и продолжительными эпизодами банальных инфекций и неадекватным подавлением их синтеза в период реконвалесценции [3].
Достаточно большой интерес как научный, так и клинический представляет исследование уровня ЦК у больных РА при наличии сопутствующих заболеваний и с позиций коморбидной патологии. Лисицыной Т.А. и соавт. (2013) было проведено исследование, целью которого было определить взаимосвязь между депрессивными расстройствами, когнитинвыми нарушениями, болью и изменениями концентрации провоспалительных ЦК (ФНО-α, ИЛ-1β, ИЛ-6) у пациентов с РА. В итоге был подтвержден факт ассоциации увеличения уровня ФНО-α, ИЛ-1β, ИЛ-6 у пациентов с депрессивными расстройствами и когнитивными нарушениями (роль хронического воспаления в патогенезе данных заболеваний). Помимо этого высокие значения ФНО-α и ИЛ-1β положительно коррелировали с усталостью (шкала FSS) и болью (шкала BPI) [24]. Особенности дисбаланса цитокинового профиля при сочетании РА со спондилоартритом достаточно хорошо освещены в работе Лебединской О.А. и соавт. (2016). Согласно результатам исследования, данный клинический «тандем» характеризуется достоверно более высокими в сравнении со здоровыми лицами показателями ИЛ-8 и моноцитарного хемоаттрактного протеина [23]. В настоящее время сердечно-сосудистые заболевания являются наиболее актуальной проблемой современной медицины. Основными в структуре заболеваемости являются ишемическая болезнь сердца и цереброваскулярная болезнь, и первое место среди причин развития данных патологий занимает атеросклероз [22]. Сочетание в анамнезе пациентов аутоиммунных заболеваний (РА, псориаз) и атеросклероза характеризуется высокой смертностью, и в связи с этим фокус внимания научного обращен на изучение общих аспектов патогенеза атеросклероза и аутоиммунной патологии, а именно на взаимосвязь между механизмом интеграции липидов и иммунным ответом. Исходя из этого, можно сказать, что понимание роли цитокиновых сетей и оценки их влияния в данном контексте позволяет нам сформировать совокупность критериев выбора препаратов (антиатерогенный, противовоспалительный и иммуномодулирующий эффекты) [39]. Комендантова Н.С. и соавт. (2013) в своём исследовании отмечают факт значительного повышения уровней ИЛ-1β, ФНО-α, ИЛ-10 у больных РА, указывающий на выраженность хронического аутоиммунного воспаления и тенденцию повышения уровня кардиоваскулярного риска [19]. В 2013 году Шилкиной Н.В. и Бутусовой С.В. была установлена положительная взаимосвязь между значениями шкал активности ревматических заболеваний (РА-DAS28 и красная волчанка – SLAM, SLEDAI) и маркерами эндотелиальной дисфункции – рост активности ревматических заболеваний сопровождался прогрессированием дисфункции эндотелия [40]. Князева Л.И. и соавт. (2014) утверждают, что результаты цитокинового повреждения при РА могут варьировать в зависимости от длительности течения РА, гиперпродукция ФНО-α и ИЛ-1β на ранних стадиях РА приводит к дисфункции эндотелия в большей степени на микроциркуляторном уровне, а избыточная продукция ИЛ-6 в сочетании с C-реактивным белком (СРБ) при длительности течения заболевания более 2 лет потенцирует развитие макрососудистой эндотелиальной дисфункции, причём в большей степени у пациентов с серонегативным по ревматоидному фактору/антителам циклическому цитруллинированному пептиду РА [18].
По мнению Джиджихия К.М. и соавт. (2013), дисфункцию эндотелия сосудов можно считать отдельным звеном патогенеза артериальной гипертензии [10], а Усачева М.Н. и Солоденкова К.С. отмечают присутствие положительной корреляционной связи уровня системного иммунного воспаления и активности РА со степенью артериальной гипертензии [33].
Согласно современным источникам ДОА является хроническим дегенеративным заболеванием суставов, сопровождающимся прогрессирующей деструкцией хряща, утолщением субхондральной кости, формированием остеофитов, дегенеративными изменениями в структуре связок и менисков и гипертрофией суставной капсулы. ДОА является мультифакторным заболеванием и среди возможных факторов риска ДОА выделяют пожилой возраст, ожирение, наследственность и травмы суставов. Отдельное положение в структуре причин развития ДОА занимает цитокиновое повреждение [42].
Патогенез ДОА выглядит следующим образом:
- Снижение сопротивляемости матрикса нагрузке вследствие потери протеогликанов;
- Истончение поверхностных слоев хряща;
- Разволокнение пластинки;
- Образование трещин вплоть до полного исчезновения хряща.
В течение ДОА имеют значение такие представители семейства ЦК как ИЛ-1β, -4, -6, -17, -18 и ФНО-α. В хондроцитах действие этих ЦК приводит к повышению синтеза протеаз, снижению синтеза протеогликанов, тканевого ингибитора металлопротеаз, прогрессированию процессов катаболизма в хряще и усилению разрушения компонентов хрящевого матрикса. На сегодняшний день мнения исследователей все больше сходятся в том, что развитие ДОА начинается хроническим синовиитом, субхондральной кости и связочном аппарате. Воспаление в этих структурах приводит к возникновению синовиита, остита, энтезитов. В исходе воспаления – формирование остеофитов и деструкция суставной поверхности. Исходя из этого, можно сделать выводы о значимости медиаторов воспаления, чье влияние распространяется на все ткани сустава [4, 41]. Несмотря на то, что остеартроз нельзя назвать артропатией в привычном понимании это термина, ввиду отсутствия в синовиальной жидкости нейтрофилов и системного воспаления, однако несомненна роль ЦК в резорбции хряща при данном заболевании [13]. ИЛ-1β можно назвать основным провоспалительным ЦК, для которого характерно многообразие биологических функций, в частности вазодилатирующий эффект за счет активации простагландинов и оксида азота, стимуляция синтеза прокоагулянтов и активация адгезионных молекул, подавление синтеза альбумина, стимуляция секреции белков «острой фазы», стимуляция коллагеназы и индукция гиперкальциемии, блокирование функции гладкомышечных клеток и кардиомиоцитов, а также ИЛ-1, что приводит к выраженной индукции синтеза всех провоспалительных ЦК – ФНО-α, ИЛ-6, ИЛ-2, колониестимулирующего фактора –гранулоцитов-моноцитов, ИЛ-4, что проявляется активацией как клеточного, так и гуморального иммунного ответа [38]. ИЛ-4 – это противовоспалительный ЦК, которому принадлежит ключевая роль в регуляции клеточной активности. Также он активирует пролиферацию и повышает функциональную активность В-лимфоцитов, а также индуцирует продукцию IgE и IgG активированными В-лимфоцитами, стимулируя гуморальное звено иммунитета [16]. Основываясь на данных исследования Копыловой Д.А. (2012) по уровню ИЛ-4 у больных ДОА ей отмечена отрицательная корреляционная связь между концентрацией ИЛ-4 и выраженностью болевого синдрома (индекс WOMAC, альгофункциональный индекс Лекена, индекс ВАШ), а также перспективность использования ИЛ-4 в качестве индикатора тяжести проявлений ДОА [20]. ИЛ-6 также является провоспалительным ЦК (одним из наиболее активных), и повышение его концентрации всегда сопровождает активное течение воспалительного процесса [32]. ИЛ-17 можно назвать своего рода «посредником» между адаптивным и врожденным иммунитетом, а также он является индуктором таких провоспалительных факторов, как ФНО-α, ИЛ-6 и ИЛ-1β. ИЛ-18 является регуляторным ЦК и является костимулятором продукции ИФН-γ Т-клетками, а также стимулирует высвобождение ИЛ-2, пролиферацию и перфорин-опосредованную активность натуральных киллеров и, по мнению Анисимовой Н.Ю. и соавт. (2011), ИЛ-18 является весьма значимым в течение воспалительного процесса [2]. ФНО-α играет важную в процессе иммунорегуляции, развитии воспаления и нарушениях гемодинамики при различных заболеваниях (инфекционной и неинфекционной природы), является индуктором апоптоза (путем активации каспаз-3 или каспаз-8) и может быть использован в комплексном анализе в качестве неспецифического маркера для оценки степени воспалительного процесса в динамике [35].
Понимание механизма цитокин-индуцированного воспаления может быть полезно для предупреждения осложнений. Чепелева М.В. и соавт. (2014) исследовали частоту развития асептической нестабильности у пациентов, перенесших операцию эндопротезирования коленного сустава и установили, что наиболее высокий коэффициент корреляции наблюдался у таких показателей как ИЛ-6 и ФНО-α [36]. Larsson S. et al. отмечают связь уровней ИЛ-6 и ФНО-α с прогрессированием остеоартрита у пациентов с перенесенной менискэктомией в анамнезе [44]. Опираясь на эти данные, можно утверждать диагностическую ценность вышеназванных ЦК в диагностике и лечении пациентов с ДОА.
Сопутствующая патология при ДОА интересна в первую очередь своим влиянием на цитокиновый профиль. Журавлева Л.В. и Олейник М.А., имея данные об уровне ЦК у пациентов с сахарным диабетом 2 типа, остеоартрозом и ожирением, отмечают, что наиболее высокие значения провоспалительных цитокинов (ИЛ-1β и ФНО-α) были зарегистрированы в группе больных с диагнозом остеоартроз и сахарный диабет 2 типа и ожирение. Высокие концентрации ЦК в этом случае коррелировали с более тяжелыми рентгенологическими изменениями, большей функциональной недостаточностью и более выраженным болевым синдромом, что очевидно говорит об их влиянии на деградацию суставного хряща, развитие воспаления в суставе и выраженность болевого синдрома при ДОА [12]. Говоря о коморбидном ожирении, нельзя не упомянуть способность подкожно-жировой клетчатки к секреторной активности. Лептин является своего рода маркером ожирения, так как его содержание увеличивается параллельно с индексом массы тела. При развитии лептиновой десинсибилизации концентрация лептина в крови достаточно высока, но главный эффект лептина – снижение аппетита не реализуется [21]. По мнению Sartori-Cintra A. R. и соавт. (2014), лептиновая десенсибилизация играет важную роль в патогенезе ДОА, оказывая влияние на ЦК (положительные корреляции с уровнями ФНО-α и ИЛ-1β, индукция транскрипции супрессоров цитокиновой сигнализации (SOCS3)) [47]. Также нашлось место в структуре коморбидных состояний гипертонической болезни. Гипертоническая болезнь у больных ДОА может являться весьма неблагоприятным прогностическим фактором. По мнению Бычкова А.А. и Бычковой Н.Г. (2015), у пациентов с гипертензией и ДОА отмечается цитокиновый дисбаланс [6]. Цель их научной работы заключалась в оценке изменений показателей иммунного и цитокинового статуса у больных артериальной гипертензией с ДОА в динамике комплексного лечения, и полученные данные выглядели следующим образом: содержание ФНО-α было выше величины у здоровых лиц в 2,66 раза, ИЛ-1β в 2,65 раз, ИЛ-6 в 6,29 раза, ИЛ-8 в 2,2 раза, и помимо это было обнаружено компенсаторное снижение противовоспалительного ИЛ-4 в 1,9 раза. Анализируя результаты своей исследовательской работы, ученые говорят о том, что у больных гипертонической болезнью при ее сочетании с ДОА наблюдаются изменения в иммунной системе, проявляющиеся иммуновоспалительными и аутоиммунными реакциями. И даже несмотря на проведенное комплексное лечение, уровень ЦК у пациентов с сопутствующей патологией ДОА и АГ по сравнению с группой здоровых лиц снизился незначительно. Ко всему прочему в материалах исследования сообщается, что у больных было зарегистрировано высокое количество активированных лимфоцитов с фенотипами CD25+, HLA-DR+, CD54+, CD95 +. Появление этих в периферической крови может говорить о развитии иммунного ответа, обусловленного действием цитокина ИЛ-1. Нет сомнений в том, что значительную роль в повышении содержания активированных субпопуляций у больных сыграли и морфологические изменения в органах – мишенях гипертонии – почки, сердце, сосуды, поражение которых сопровождается аутоиммунизацией к собственным тканям.
Патогенез РА и ДОА имеет достаточно много общих аспектов. В частности то, что повышение уровня ЦК в синовиальной жидкости является основной причиной прогрессирования воспаления суставов при РА и остеоартрите. Наиболее важным звеном в развитии воспалительного процесса в данном случае является экспрессия ЦК, металлопротеиназ и синовиоцитов на фоне низкой активности SOCS, чьей функцией является отрицательная регуляция JAK/STAT [45]. Изучение эффектов ЦК и их взаимодействия непосредственно в полости сустава при различных артропатиях представляет огромный интерес для ученых. Будучи заинтересованными связью синовиального ИЛ-17 и продукцией IgA слизистыми Eliçabe R.J. и соавт. (2017) провели эксперимент, главной целью которого являлась характеристика данной связи и понимание ее механизма. Проводилось изучение invitro синовиальной жидкости (пунктата) пациентов с РА, остеоартритом и спондилоартритом. В ходе работы определялись концентрации ИЛ-17, ИЛ-6, IgA, BAFF (В-клеточный фактор активации), трансформирующего фактора роста-β1 (ТФР — β1) и антиэндотоксиновых антител (анти-ЛПС-IgA), осуществлялось внешнее воздействие на экспериментальную среду путем введения бактериальных антигенов. По итогам данной работы была установлена положительная связь между уровнем ИЛ-17 и продукцией анти-ЛПС-IgA в суставе, не зависящая от уровня ИЛ-6, концентрация в синовиальной жидкости ТФР-β1 и BAFF коррелировала с уровнем анти-ЛПС-IgA и общим IgA, при блокаде продукции ИЛ-17 достоверно уменьшалось содержание ТФР-β1 и анти-ЛПС-IgA. Подводя итог, можно отметить, что ТФР-β1, BAFF и бактериальные антигены являются в данном случае своего рода детерминантами воздействия ИЛ-17 на продуцирование IgA. Данную работу можно смело назвать очередным шагом в понимании патогенеза воспалительных заболеваний суставов [43]. Помимо цитокинов синовицитами в ходе РА и ДОА продуцируются хемокины, такие как хемоаатрактные ЦК, которые представляют собой небольшие катионные белковые молекулы, синтезирующиеся в клетках и тканях в ходе иммунной реакции организма на появление патогена, аллергена, повреждение и контролирующие природу и величину инфильтрации иммунных клеток. Все хемокины можно дифференцировать на 4 группы:
2. CXC (CXCR или CXCL);
3.С (XCL1 bXCL2); 4.CX3C (CX3CL1) [17].
Маслянский А.Л. и соавт. (2016) отмечают уникальность спектра ЦК и хемокинов в синовиальной жидкости для дифференциальной диагностики таких заболеваний как РА и ДОА, осложненного вторичным артритом, в частности хемоаттрактант B-клеток и CXCR5, а также возможное значение B-клеточного звена (повышение экспрессии м-РНК фактора, продуцируемого стромальными клетками в патогенезе ДОА [25].
Итак, основываясь на мнении различных авторов, как российских, так и зарубежных, мы можем с уверенностью отметить важность цитокинового звена в патогенезе РА и ДОА. Изучение цитокиновых сетей и изменений в их структуре, анализ корреляционных связей между изменениями концентраций ЦК относительно друг друга, а также в сочетании с другими различными факторами, непосредственно актуализированными в процессе диагностики и лечения пациента, является перспективным направлением современной медицины. Разработка и совершенствование медикаментозных препаратов, способных точечно воздействовать на тех или иных представителей цитокинового спектра, позволит в корне изменить подход к лечению РА и ДОА, так как, эффективно воздействуя на основное звено патогенеза, можно изменить ход заболевания и тем самым увеличить шансы пациента на выздоровление.
Статья написана по материалам сайтов: diartroz.ru, medside.ru, www.eurolab.ua, science-education.ru.
»