Ревматоидный артрит может быть побежден с помощью генной инженерии
Самые древние «отметины» этой болезни были найдены на остатках скелетов индейцев в Теннесси, США, умерших примерно в 4500 г. до н. э. Прошло немало времени, пока заболевание получило название «ревматоидный артрит». В 1859 году его впервые в официальной медицине описал английский врач Гаррод.
До сих пор ревматоидный артрит относится к трудноизлечимым болезням. Больные испытывают постоянные боли, функции суставов нарушаются, что в конце концов приводит к инвалидности. Но наука не стоит на месте, и сейчас у таких больных появился реальный шанс на выздоровление.
О том, как можно победить болезнь, мы беседуем с профессоров Дмитрием Евгеньевичем Каратеевым, руководителем отдела ранних артритов Научно-исследовательского института ревматологии РАМН.
Ревматоидный артрит считается аутоиммунным системным заболеванием. Что это значит?
— Артрит — это сбой в работе иммунной системы, из-за чего происходит избыточная активация иммунных клеток. В норме они защищают организм от чужеродных агентов, например, от инфекции, но при патологии начинают вырабатывать зашитные тела против самого организма. В общем это слишком интенсивная работа иммунной системы, в отличие, например, от излишне слабой работы (иммунодефицита), например, при СПИДе или некоторых врожденных заболеваниях.
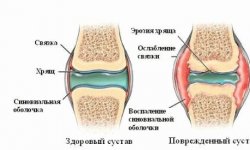
Словосочетание «системное заболевание» означает, что ревматоидный артрит так же как другие воспалительные ревматические болезни (болезнь Бехтерева, системная красная волчанка и др.) не является заболеванием только суставов, а страданием всего организма. При артрите развиваются системные проявления — поражение кожи, внутренних органов, например, почек.
Точные причины ревматоидного артрита до сих пор неизвестны. Какие на сегодняшний день считаются наиболее вероятными?
— Известны различные факторы, связанные с развитием артрита: это курение (риск увеличивается в 2-3 раза), генетическая предрасположенность, инфекция, чаще носоглоточная, воспалительные заболевания зубов и десен, стрессы. Однако ни один из названных факторов не может сам по себе вызвать артрит. Есть обоснованное мнение, что артрит — заболевание мультифакториальное, т.е. возникающее от сочетания множественных факторов.
Почему женщины болеют артритом чаще, чем мужчины?
— Существует взаимосвязь с уровнем женских гормонов эстрогенов в крови, не зря прием гормональных контрацептивов — один из обсуждавшихся факторов риска возникновения болезни.
В прошлом году наша страна поддержала международную инициативу по совершенствованию ведения больных с ревматоидным артритом Treat to Target (T2T) – лечение до достижения цели. А что, раньше этим не занимались?
По тяжести артрит сопоставим с ишемической болезнью сердца, сахарным диабетом 2 типа, даже с некоторыми видами злокачественных заболеваний (в частности, с некоторыми видами лимфом). При этом, если у человека артрит, точно оценить его состояние очень сложно, что тоже мешало медицине прошлых лет. В наши дни стали доступны совершенно новые биологические генно-инженерные препараты для лечения артритом, появилась реальная возможность помочь многим ранее не поддававшимся терапии пациентам. Сейчас мы можем говорить о том, что у 40-50% больных на ранней стадии болезни реально достигнуть клинической ремиссии – состояния, когда признаки болезни отсутствуют. У больных, страдающих РА уже 2-3 года и более, этот процент ниже, но у них реально добиться стойко низкой активности болезни – без сильной боли и обострений, с сохранением подвижности (если, конечно, суставы еще не разрушены).
Вы упомянули о лечении принципиально новыми генно-инженерными биологическими препаратами. Что это за лекарства и как они действуют на больной организм?
— С помощью генной инженерии была разработана эта новая группа препаратов. В мире из них официально зарегистрировано 9 препаратов, из них в нашей стране используется 7, еще несколько лекарств из этой группы находятся на разных стадиях апробации. Они производятся по сложнейшей технологии в Европе, Японии, США. К сожалению, в России эти биологические препараты пока не делают. Это искусственные молекулы (антитела или регуляторные белки), которые синтезируются с помощью сложных биотехнологий с участием специально созданных клонов клеток.
Так как артрит заболевание аутоиммунное, необходимо в первую очередь нормализовать работу иммунной системы, приостановить излишнюю ее активность. Биологические препараты действуют, избирательно блокируя вещества, вызывающие воспаление, или подавляя конкретные неправильно работающие клетки иммунной системы, которые активизируют иммунитет и выделяют вещества, которые вызывают хроническое воспаление.
Какие еще лекарственные препараты способны подавлять не в меру разбушевавшийся иммунитет?
— Лучшим препаратом, «золотым стандартом» до сих пор считается метотрексат, тот самый, который применяют при лечении новообразований. Но при лечениии артрита его используют в несколько раз меньшей дозе, поэтому он сравнительно хорошо переносится больными при длительном применении. Но не у всех пациентов болезнь восприимчива к этому лекарству.
Насколько важную роль в лечении играет диета?
— Она не настолько важна, как лекарственная терапия, и не относится к достоверным факторам риска. В данном случае надо, скорее, с помощью диеты компенсировать те нарушения, которые наносит болезнь: наши пациенты сильно худеют, т.е. отмечается выраженный недостаток мышечной массы, у них выявляют остеопороз. Нужно питание, богатое белком, витаминами, кальцием. И обязательно включить в меню растительное масло — там находятся очень полезные для больных жирные кислоты.
А какая может быть профилактика ревматоидного артрита?
— Первичная профилактика, т.е. та, которая предупреждает развитие заболевания, очень доступна: не курить, избегать инфекционных заболеваний, избегать стрессов, в общем, поддерживать здоровый образ жизни.
Как еще врачи-ревматологи могут помочь больным?
— Врачи-ревматологи нашего НИИ проводят «Школу пациентов», причем она бесплатная для больных и, замечу, для врачей тоже, они работают на голом энтузиазме. Это инициатива врачебной Ассоциации ревматологов России. Думаю, что мы докажем на собственном примере, что такие Школы хорошо работают.
Содержание
- Генная инженерия при ревматоидном артрите: лечение, отзывы
- Отличия Диаскинтеста и Манту
- Разновидности
- Побочные эффекты инъекции ДСТ
- Диаскинтест: инструкция по применению
- Противопоказания
- Доступность ревматологической помощи сэкономит бюджет Минздрава
- Генная инженерия ревматоидный артрит
- Генно инженерное биологическое лечение ревматоидного артрита
- Генно – инженерные биологические препараты (ГИБП)
- Биологические агенты при лечении ревматоидного артрита
- Современное лечение ревматоидного артрита и других ревматологических заболеваний с применением генно-инженерных биологических препаратов
- Лечение ревматоидного артрита биологическими препаратами
- Краткий обзор
- Достоинства терапии
- Разновидности
- Прием лекарств
- Побочные эффекты
- Подводя итоги
Генная инженерия при ревматоидном артрите: лечение, отзывы
Отличия Диаскинтеста и Манту
Оба приведенных метода используются для диагностики туберкулеза. Они позволяют понять, есть ли в крови бактерии-возбудители, что можно и нужно сделать для лечения пациента.
В отличие от других лабораторных исследований (рентгенография, КТ) они не приводят к облучению организма, а потому считаются безопасными для взрослых и детей. Вероятность заразиться опасным недугом после сделанной прививки полностью исключена.
Можно ли мочить Диаскинтест? Как при Манту, место, где была игла, не рекомендуется подвергать воздействию влаги. Почему? Это может смазать результаты проведенного теста.
Отличие методик заключается в том, что Манту демонстрирует, встречался ли организм с вредоносной палочкой Коха ранее. Она может показать, что человек уже страдал этим заболеванием или был привит БЦЖ: в крови остались следы.
Диаскинтест реагирует только на активные бактерии, способные вызвать туберкулез в будущем. Он не реагирует на последствия БЦЖ или среду, не вызывающую опасный недуг. Это позволяет использовать такой метод для дифференциальной диагностики, если проведенная ранее Манту дала положительный результат и нужно понять, чем он вызван.
Разновидности
При генно-инженерной терапии РА могут применяться следующие виды лекарств:
- Производимые на основе антител мышей. Эти медикаменты (Инфликсимаб) считаются средствами 1 поколения, уже значительно устарели и применяются довольно редко.
- Лечебные средства гуманизированного типа, представляющие собой гибрид антител мышей и человеческих клеток с высоким уровнем взаимодействия.
- Биопрепараты на основе иммунных клеток человека – самые действенные и популярные в генной медицине. Их наименований очень много – Алемтузумаб, Рамуцирумаб, Элотузумаб, Трастузумаб, Блинатумомаб.
- Биологические лекарства от ревматоидного артрита, на четверть состоящие из мышиных антител (Ремикейд).
Побочные эффекты инъекции ДСТ
Биологическое лечение РА – процесс длительный. Лекарства генной инженерии предназначены для инфузионного введения. Лекарства вводят постепенно, строго регулируя дозировки и отслеживая реакцию организма.
До назначения лечебного курса доктора направляют пациента на лабораторное исследование внутрисуставной жидкости. Конкретный препарат, дозировку и длительность его применения выбирается исходя из результатов этого анализа.
Существует ряд правил, которые традиционно следует соблюдать после теста на туберкулез в течение первых 3 дней, до того как тест будет измерен:
- Так как ДСТ состоит из аллергенного белка, то мочить прививку после процедуры в течение 75 часов не рекомендуется. Можно помыться сразу после замеров результата.
- Не стоит тереть «пуговку» и парить в бане.
- Воздержитесь три дня от занятий спортом, так как пот усилит реакцию и отрицательный тест может стать положительным.
- Не стоит после реакции на туберкулез загорать и плавать.
- Мороз может пагубно отразиться на реакции ДСТ.
- Нельзя чесать мест укола и область вокруг него. Если зуд невыносимый, можно слегка погладить пуговичку.
Ставить Диаскинтест должен опытный специалист, так как от качества подкожной инъекции будет зависеть, насколько точным будет тест.
Побочных эффектов у Диаскинтеса мало, так как препарат нового поколения. К выявленным осложнениям относятся:
- Невысокая температура вечером после укола.
- Аллергическая реакция на белок: одышка, зуд тела, отек слизистой носоглотки, покраснение глаз.
- У людей пожилого возраста возможны скачки давление. Но связаны они не столько с препаратом, сколько с переживаниями в ожидание результата.
Предупредить побочные эффекты можно, если провести правильную подготовку к инъекции диаскинтест и соблюдать все наши рекомендации. Не стоит пренебрегать советами и если у вас есть противопоказания от теста лучше воздержаться.
Диаскинтест: инструкция по применению
Проба проводится по назначению врача детям, подросткам и взрослым специально обученной медицинской сестрой, имеющей допуск к проведению внутрикожных тестов. Препарат вводят строго внутрикожно.
Для проведения пробы применяют туберкулиновые шприцы и тонкие короткие иглы с косым срезом. Перед употреблением необходимо проверить дату их выпуска и срок годности.
Флакон с препаратом после вскрытия допускается хранить не более 2 часов. Шприцем набирают 0,2 мл (две дозы) препарата Диаскинтест и выпускают раствор до метки 0,1 мл в стерильный ватный тампон.
Пробу проводят обследуемым в положении сидя. После обработки участка кожи на внутренней поверхности средней трети предплечья 70% этиловым спиртом, в верхние слои натянутой кожи параллельно ее поверхности вводят 0,1 мл препарата Диаскинтест. При постановке пробы, как правило, в коже образуется папула в виде «лимонной корочки» размером 7 –10 мм в диаметре беловатого цвета.
Лицам, у которых в анамнезе имелись проявления неспецифической аллергии, пробу рекомендуется проводить на фоне приема десенсибилизирующих препаратов в течение 7 дней (5 дней до постановки пробы и 2 дня после нее).
Учет результатовРезультат пробы оценивают врач или обученная медсестра через 72 ч с момента ее проведения путем измерения поперечного (по отношении к оси предплечья) размера гиперемии и инфильтрата (папулы) в миллиметрах прозрачной линейкой.
Гиперемию учитывают только в случае отсутствия инфильтрата. Ответная реакция на пробу считается:
- отрицательной — при полном отсутствии инфильтрата и гиперемии или при наличии «уколочной реакции» до 2 мм
- сомнительной — при наличии гиперемии без инфильтрата
- положительной — при наличии инфильтрата (папулы) любого размера.
Положительные реакции на ДИАСКИНТЕСТ условно различаются по степени выраженности:
- слабо выраженная реакция — при наличии инфильтрата размером до 5 мм
- умеренно выраженная реакция — при размере инфильтрата 5 –9 мм
- выраженная реакция — при размере инфильтрата 10 –14 мм
- гиперергическая реакция — при размере инфильтрата 15 мм и более, при везикуло-некротических изменениях и (или) лимфангоите, лимфадените независимо от размера инфильтрата.
Лица с сомнительной и положительной реакцией на ДИАСКИНТЕСТ обследуются на туберкулез. В отличие от реакции гиперчувствительности замедленного типа, кожные проявления неспецифической аллергии (в основном гиперемия) на препарат, как правило, наблюдаются сразу после постановки пробы и через 48 –72 часа обычно исчезают.
Препарат Диаскинтест не вызывает реакции гиперчувствительности замедленного типа связанной с вакцинацией БЦЖ. Реакция на Диаскинтест как правило отсутствует:
- у лиц, не инфицированных Mycobacterium tuberculosis
- у лиц, ранее инфицированных Mycobacterium tuberculosis с неактивной туберкулезной инфекцией
- у больных туберкулезом в период завершения инволюции туберкулезных изменений при отсутствии клинических, рентгено-томографических, инструментальных и лабораторных признаков активности процесса
- у лиц, излечившихся от туберкулеза.
Проба делается квалифицированным медицинским персоналом, с навыками введения внутрикожных инъекций. Диаскинтест применяется строго по назначению врача для взрослых, подростков и детей. Для проведения операции нужен туберкулиновый шприц и короткая тонкая игла с косым срезом.
Перед началом введения обязательно проверяется дата выпуска раствора и шприца, их срок годности. Проба проводится на внутренней стороне предплечья посредине между плечом и локтем. Этот участок кожи обрабатывают 70-процентным этиловым спиртом. Специалист вводит раствор параллельно к кожной поверхности. Возможно появление беловатой корочки в размере 6-10 миллиметров.
Противопоказания
Диаскинтест противопоказания сводятся к минимуму, потому что средство относится к препаратам последнего поколения. Этот медикамент разрешен беременным, детям, пожилым людям. Потенциальная опасность доя организма близка к нулю.
- Если человек страдает инфекционными болезнями (ОРЗ, простуда и т.д.). Характерные проявления этих состояний, которые должны насторожить пациента, – кашель, сопли, повышение температуры.
- Обострения хронических заболеваний (например, пиелонефрита, гепатита ). Вакцинация способна ухудшить и без того неблагоприятное состояние пациента.
- Эпилепсия.
- Аллергические состояния.
- Кожные дерматиты, гнойные высыпания.
- Действие другой вакцины. Между двумя прививками должно пройти не менее 30 дней.
Профилактическое введение Диаскинтеста не рекомендовано, если высока вероятность заражения вирусной инфекцией, например, если человек находится на карантине. Практика показывает, что вероятность получения ложного значения теста повышается в разы.
Можно ли делать Диаскинтест при насморке? Ставить укол при таких симптомах не рекомендуется, так как они могут быть проявлением ОРЗ или ОРВИ. Рекомендуется дождаться полного выздоровления.
Рекомендуется воздержаться от прививок тем больным, которые страдают разными видами аллергии. Например, при бронхиальной астме или аллергическом рините укол не противопоказан, но пациента нужно предупредить о возможных последствиях.
За неделю до процедуры нужно начать прием антигистаминных препаратов: Супрастина, Зодака или других. Если предварительная подготовка не будет пройдена, возможны серьезные осложнения: бронхит, трахеит.
С какими показаниями связано применение Диаскинтеста? Он позволяет выявить наличие возбудителей туберкулеза в крови, поэтому используется как для лечения болезни, так и для ее диагностики.
Диаскинтест предназначен для постановки внутрикожной пробы во всех возрастных группах с целью:
- диагностики туберкулеза, оценки активности процесса и выявления лиц с высоким риском развития активного туберкулеза
- дифференциальной диагностики туберкулеза
- дифференциальной диагностики поствакцинальной и инфекционной аллергии (гиперчувствительности замедленного типа)
- оценки эффективности противотуберкулезного лечения в комплексе с другими методами.
- острые и хронические (в период обострения) инфекционные заболевания за исключением случаев подозрительных на туберкулез
- соматические и др. заболевания в период обострения
- распространенные кожные заболевания
- аллергические состояния
- эпилепсия.
В детских коллективах, где имеется карантин по детским инфекциям, проба проводится только после снятия карантина.
Тест проводится начиная с 1 года жизни. Чтобы результат был достоверным, место введения препарата нужно содержать в покое. Нельзя:
- допускать расчесывания и расцарапывания кожи;
- посещать бассейн, принимать ванну, мочить руку;
- туго заматывать место прививки, бинтовать руку;
- мазать место введения зеленкой, йодом, фукорцином.
Попадание воды не влияет на результаты теста, но в воде иногда содержатся различные посторонние вещества, которые могут вызвать аллергическую реакцию. Особенно важно не посещать бассейн с хлорированной водой. Проверка результата проводится через 3 суток с момента введения препарата. Диаскинтест имеет следующие особенности:
- не вступает в реакцию с БЦЖ и другими прививками;
- обладает высокой специфичностью, не дает ложных результатов, как реакция Манту;
- редко вызывает аллергию у детей;
- проходит обычно без повышения температуры.
Если после теста температура более 39°С, нужно вызывать скорую помощь. Особенно внимательно следует наблюдать за теми детьми, у которых есть кожная, дыхательная или пищевая аллергия.
Детям с аллергией нужно начинать антигистаминную терапию не позднее чем за 1 неделю до проведения прививки. Положительный результат Диаскинтеста проявляется как круглое пятно на месте инъекции, диаметр пятна — более 5 мм.
В случае положительного результата ребенку назначаются дополнительные исследования:
- консультация фтизиатра;
- рентген грудной клетки;
- анализ крови и мочи.
Повторное проведение теста возможно сразу после того, как пройдет покраснение на коже. Распространенная причина для ложноположительной реакции — это гематома в месте укола.
Раствор для инъекции вводится подкожно. До проведения прививки нужно применить педагогический талант, чтобы ребенок был мотивирован на инъекцию.
Тогда во время введения препарата он будет вести себя спокойно и не затруднять работу врача.
Гематома выглядит как синее пятнышко в точке прокола кожи. Постепенно синий цвет сменяется на желто-зеленый. Из ложноположительных результатов чаще всего отмечается гипераллергическая реакция.
Доступность ревматологической помощи сэкономит бюджет Минздрава
О болезни и связанных с её лечением проблемах «ЭЖ» рассказывает заместитель директора по научной работе ФГБУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой» профессор, д.м.н. Дмитрий Каратеев:
— Если мы говорим не о ранней стадии заболевания, а о поздней, процент тяжёлых пациентов будет увеличиваться. Через два года болезни уже 30—50% больных нуждаются в дорогостоящем лечении. В этих условиях оптимизировать стоимость терапии крайне важно. Мы должны знать, сколько теряет государство, если оно вовремя не лечит больного.
— Кто в зоне риска?
— Ревматоидный артрит чаще всего встречается у лиц белой расы. Наиболее подвержены заболеванию народы Северной Европы — скандинавы, англосаксы, немцы, славяне. Всего ревматоидным артритом страдает 1% населения земного шара. От 0,5—1% — у мужчин и 1,5—3% в США и Англии — у женщин. Это связано с генетической предрасположенностью иммунного ответа организма.
— Появляются ли новые эффективные методы лечения?
— В ревматологии за последние 15 лет во всём мире наблюдается колоссальный прогресс как в диагностике, так и в лечении. Ещё в 1999 г. был зарегистрирован уникальный генно-инженерный препарат. Была найдена одна из тех ключевых молекул, которые связаны с воспалительным процессом, и разработан способ её блокирования. В результате появился метод терапии генно-инженерными биологическими препаратами. Сейчас в России зарегистрировано восемь таких инъекционных препаратов против ревматоидного артрита. А в 2013 г. у нас появился и таблетированный синтетический препарат с близким механизмом действия. Наши исследования показывают, что потребность в этих биологических препаратах примерно в два раза ниже у пациентов с ранним ревматоидным артритом, большинству из них хорошо помогают обычные препараты.
— Обычные — это какие?
— Есть принятые стандарты лечения?
— Единых международных стандартов не существует. Есть международные (европейские) и различные национальные клинические рекомендации, которые сходятся в общем понимании стратегии лечения. Она сформулирована в международных принципах «Лечения до достижения цели» (Treat to target). Сейчас ремиссия во всех клинических рекомендациях позиционируется как основная цель лечения, и во многих странах продолжительность жизни больного, получающего адекватное лечение, сравнима с популяционной. Согласно этим принципам больные так же ответственны за результат лечения, как и врачи, они должны посещать ревматолога не реже чем один раз в три месяца, а врач должен тщательно оценивать их состояние и подбирать терапию для достижения ремиссии или как минимум низкой активности болезни. Благодаря этой стратегии достигнут очень большой успех в лечении, больше чем во многих других отраслях медицины.
— Каковы шансы больного достичь ремиссии?
— Ещё в 90-х г. частота достижения ремиссии при ревматоидном артрите составляла всего 5—10%, а продолжительность их жизни укорачивалась на 7—10 лет по сравнению с общей популяцией. Сегодня можно говорить о том, что у каждого больного есть высокие шансы на ремиссию. В том числе и благодаря генной инженерии. Повторяю, что России зарегистрированы восемь препаратов из группы ГИБП, так что выбор достаточно велик. Препараты могут назначаться в рамках системы госгарантий. Назначение даёт специальная комиссия ревматологов. ГИБП могут применяться на разных стадиях болезни, но наилучший эффект можно ожидать на ранних стадиях, впервые 1—2 года от начала заболевания.
— Что же — нет проблем, недуг побеждён?
— Сложная бюрократическая система возмещения расходов на лечение должна быть упрощена. Параллельно требуется улучшить контроль над качеством работы врачей. Есть больные, которым дорогостоящие высокотехнологичные препараты назначаются необоснованно, у них можно достичь улучшения другими, менее дорогими методами, а есть больные, которых лечить дешёвыми методами просто не получится. Не все врачи в регионах имеют современный уровень подготовки. Между тем как в крупных ревматологических центрах Российской Федерации есть все условия для ранней диагностики, а медикаментозная терапия назначается в соответствии с самыми последними международными рекомендациями. Мы — Институт ревматологии, Ассоциация ревматологов России, общими усилиями стараемся улучшить ситуацию. Российские клинические рекомендации по лечению ревматических болезней являются одними из самых современных в мире. У нас есть квалифицированные специалисты-ревматологи мирового уровня, которые правильно и своевременно ставят диагнозы, назначают правильную терапию.
— Но невозможно же всех нуждающихся направлять для осмотра и выработки рекомендаций по лечению в ваш институт или подобные крупные центры?
— Мы можем обслуживать минимум вдвое больше пациентов, чем делаем до сих пор. Но только если будет выделяться больше так называемых квот на это, чего пока не происходит. Иными словами, система пока работает так, что наш институт не на 100, даже не на 70% использует свой потенциал. Мне кажется это несколько расточительным. Я думаю, что подобным образом интенсифицировать можно работу и других крупных центров — в Санкт-Петербурге, Ярославле и т.д. При этом, если правильно наладить преемственность с первичными звеньями здравоохранения, результаты будут ещё более существенными, в том числе в экономическом плане.
Генная инженерия ревматоидный артрит
Генно инженерное биологическое лечение ревматоидного артрита
Генно – инженерные биологические препараты (ГИБП)
После курса терапии
2 инфузии по 1000 мг с промежутком 14 дней
К ГИБП относятся: ингибиторы ФНО-a (Инфликсимаб, Адалимумаб, Голимумаб, Цертолизумаб-Пэгол), рецепторов к ФНО-a (Этанерцепт), рекомбинантные антагонисты рецепторов к цитокинам (интерлейкину – 6 – Тоцилизумаб, интерлейкину – 1 — Анакинра), ингибитор ко – стимуляции Т – лимфоцитов (Абатацепт), ингибитор активации В-лимфоцитов (Ритуксимаб).
Для биологических препаратов характерны все полезные свойства, присущие БПВП (подавление воспалительной активности, торможение деструкции суставов, возможное индуцирование ремиссии), но эффект наступает, как правило, гораздо быстрее и значительно более выражен, в том числе в отношении деструкции суставов. Клинический лечебный эффект и антидеструктивное действие биологических препаратов в ряде случаев не совпадают и у ряда больных ревматоидным артритом без признаков клинического улучшения наблюдается, тем не менее, отчетливое торможение деструкции.
Показания к назначению биологической терапии при ревматоидном артрите:
• Тяжелый ревматоидный артрит, резистентный к терапии как минимум двумя БПВП (метотрексатом, лефлуномидом) в максимально эффективной и переносимой дозе;
• Ранний ревматоидный артрит при отсутствии эффекта от других БПВП в максимально переносимой дозе.
Побочные эффекты биологических препаратов:
• Инфекции, включая сепсис и туберкулез;
• Злокачественные новообразования, в том числе лимфомы;
• Гематологические нарушения (анемия, панцитемия);
• Ухудшение симптомов застойной сердечной недостаточности;
• Продукция АТ и развитие аутоиммунных реакций;
• Инфузионные и аллергические реакции.
Противопоказания к назначению биологических препаратов полностью вытекают из перечисленных выше побочных эффектов. Перед началом терапии необходимо обследование для исключения латентного туберкулеза (рентгенография легких, кожный туберкулиновый или диаскин – тест, исследование крови на квантиферон — тест).
У большинства больных блокаторы ФНО-a назначаются в комбинации с метотрексатом, но могут сочетаться и с такими базисными средствами как лефлуномид и сульфасалазин. При необходимости блокаторы ФНО-a назначаются в качестве монотерапии, но комбинация с метотрексатом превосходит монотерапию по выраженности ответа на лечение и влиянию на рентгенологическое прогрессирование. Тоцилизумаб продемонстрировал свою эффективность в виде монотерапии.
Несмотря на высокую эффективность терапии биологическими препаратами, в 20-40% случаев имеет место первичная или вторичная резистентность к лечению и лишь в 50-60% случаев удается достигнуть частичной или полной ремиссии.
После завершения курса лечения БПВП у пациентов с ревматоидным артритом, как правило, наступает обострение. Лечение внесуставных (системных) проявлений ревматоидного артрита отражено в таблице 5, анемий – в таблице 6.
Лечение внесуставных (системных) проявлений
Биологические агенты при лечении ревматоидного артрита
В последние годы отмечен большой прогресс в методах лечения ревматоидного артрита. Это утешительная новость для людей, не реагирующих на противоревматические препараты, модифицирующие течение болезни. Самым значительным достижением стало создание группы препаратов, называемых препаратами, модифицирующими биологическую реакцию, или биологическими агентами.
Существует ряд стандартных биологических агентов, предназначенных для лечения ревматоидного артрита:
Остальные биологические агенты подвергаются клиническим испытаниям относительно их воздействия на различные формы артрита.
Каким образом биологические агенты воздействуют на симптомы ревматоидного артрита?
Биологические агенты – это протеины, разработанные методом генной инженерии с использованием человеческого гена. Они направлены на модификацию функции особых ферментов иммунной системы, играющих основную роль в активизации или подавлении воспалительного процесса (главной составляющей ряда артритных заболеваний, таких как ревматоидный артрит и псориатический артрит).
Каким образом биологические агенты, существенно отличающиеся от остальных препаратов, также использующихся для лечения ревматоидного артрита, модифицируют иммунную систему? Они воздействуют исключительно на особые компоненты иммунной системы. Таким образом, теоретически эти препараты обладают меньшим спектром побочных эффектов.
Побочные эффекты биологических агентов
Так же как и другие препараты, подавляющие функцию иммунной системы, биологические агенты обладают некоторой степенью риска, поскольку организм в период их применения более уязвим и подвержен инфекционным заболеваниям. На постоянно повышенную температуру следует немедленно отреагировать соответствующим медикаментозным лечением.
Биологические агенты также могут вызвать обострение хронических заболеваний, пребывающих в ремиссии, таких как туберкулез, поэтому эти препараты не рекомендуемы при рассеянном склерозе, хронической сердечной недостаточности и других заболеваниях. Прежде чем приступить к лечению биологическими агентами, больные также должны предварительно пройти тест на туберкулез кожи.
Поскольку использование биологических агентов – в основном ранний метод лечения, их побочные эффекты известны не в полной мере, и, по всей вероятности, Вы будете принимать эти препараты под наблюдением врача. Тем не менее, согласно данным настоящих исследований, они довольно эффективны и обладают меньшим риском возникновения побочных эффектов по сравнению с остальными видами медикаментозного лечения.
Одним из недостатков терапии с использованием биологических агентов является необходимость их применения в виде инъекций или методом внутривенного вливания. Один сеанс занимает от 30 минут до нескольких часов. Тем не менее, эти препараты обеспечивают существенное улучшение состояния.
Клинические испытания с участием животных не показали негативного влияния на рождаемость или развитие плода, однако эти данные не могут гарантировать отсутствие осложнений у людей. Соответственно, женщины во время беременности должны принимать эти препараты только в случае очевидной необходимости.
Как правило, не следует использовать два биологических агента одновременно.
По словам исследователей, на стадии разработки находятся пероральные биологические агенты, которые будут намного дешевле.
Краткий обзор существующих препаратов
Енбрел уменьшает воспаление в суставах, подавляя выработку фермента, называемого фактором некроза опухолей (ФНО).
Енбрел применяется в виде подкожной инъекции раз или дважды в неделю. Многие люди учатся выполнять инъекции самостоятельно, их также может выполнять член семьи, прошедший инструктаж. Существуют комплекты для инъекций, что значительно упрощает процесс.
Енбрел может вызывать раздражение в области инъекции, которое можно ограничить, приложив холодный компресс перед выполнением инъекции.
Действие Енбрела может подавлять функционирование иммунной системы. В редких случаях может увеличиться риск подверженности инфекциям вследствие применения препарата. В случае инфекционного заболевания следует прекратить прием препарата и возобновить по наставлению врача. В этот период может понадобиться медицинское наблюдение.
Енбрел противопоказан в период беременности, поскольку его влияние на плод не известно.
Хумира также препятствует развитию фактора некроза опухолей. Препарат применяется самостоятельно в виде инъекции. Инъекция выполняется каждые две недели.
Случаи острых аллергических реакций и нарушения соотношения количества кровяных клеток вследствие применения Хумиры встречаются довольно редко. Образование гематом и кровотечения могут свидетельствовать о нарушениях функции клеток крови, о чем следует немедленно сообщить врачу.
В ходе клинических испытаний наблюдался повышенный риск инфекций вследствие применения комбинации Хумиры и другого противоревматического препарата – Кинерета.
Современное лечение ревматоидного артрита и других ревматологических заболеваний с применением генно-инженерных биологических препаратов
Современное лечение в ревматологии базируется на тщательно подобранной медикаментозной терапии, использующей все новейшие достижения медицинской науки. Это главный и наиболее эффективный вид помощи при ревматологических заболеваниях.
Обратитесь к профессионалам! Правильный подбор фармакотерапии требует обширных знаний и опыта врача-ревматолога, учёта индивидуальной клинической ситуации пациента и обязательного регулярного контроля состояния его здоровья, включая лабораторную и инструментальную диагностику, как это практикуется в нашей клинике.
Базовая фармакотерапия в ревматологии
Лекарства действуют на главный патогенетический фактор заболевания — подавляют аутоиммунную активность и оказывают прямое противовоспалительное действие. Обычно фармакотерапия в ревматологии включает приём следующих групп лекарств:
- Базисные противовоспалительные препараты – самый главный элемент медикаментозного лечения, медленно (в течение одного-трёх месяцев), но верно подавляющий активность заболевания, применяемый длительно (порой годами).
- Глюкокортикоиды — гормональные средства, обладающие мощным быстрым противовоспалительным действием. Применяются чаще кратковременно, до начала проявления эффекта базисных препаратов.
- Нестероидные противовоспалительные препараты – применяются короткими курсами, главным образом, с целью уменьшения или снятия боли.
Современное лечение в ревматологии
Детальные исследования механизмов развития аутоиммунного воспалительного процесса в последние 10-летия позволили создать новый класс лекарств – генно-инженерные биологические препараты, оказывающие избирательное точечное воздействие на ключевые звенья воспалительного процесса.
Медицинские биологические препараты, применяемые в ревматологии, представляют собой антитела человека или животных к медиаторам воспаления — молекулам передающим воспалительные сигналы (фактору некроза опухолей-#945; — ФНО-#945;, интерлейкинам, цитокинам и др. ), либо к белкам избыточно активных T и B-лимфоцитов (клеток иммунной системы).
Медиаторы воспаления – это вещества, избыточно образующиеся в организме при аутоиммунном заболевании и поддерживающие воспалительный процесс, в том числе в суставной оболочке (синовиит), сосудах (васкулит), коже. Биопрепараты блокируют их, останавливая воспаление и эрозирование хряща, разрушение прилежащей костной ткани. Позволяют гораздо быстрее (уже через несколько дней) достичь всех позитивных эффектов базисной противовоспалительной терапии (подавления аутоиммунной агрессии, стихания воспаления, прерывания обострения, сохранения суставной поверхности). Каждый препарат блокирует одно конкретное звено в воспалительном каскаде. Точечность воздействия определяет лучшую переносимость лечения и меньшее количество побочных эффектов.
Биопрепараты вводят внутривенно или в виде подкожной инъекции 1-2 раза в месяц на протяжении длительного периода (до года и больше).
Производство этих лекарств требует сложных биотехнологий и генной инженерии, что обусловливает высокую стоимость. Однако эффективность биологических препаратов стоит затраченных средств.
Виды биологических препаратов
- Инфликсимаб (Ремикейд)
- Голимумаб (Симпони)
- Адалимумаб (Хумира)
- Цертолизумаб пэгол (Симзия)
- Этанерцепт (Энбрел)
Снижающие активность интерлейкинов
- Анакинра (Кинерет)
- Тоцилизумаб (Актемра)
- Устекинумаб (Стелара)
- Канакинумаб (Иларис)
- Ритуксимаб (Мабтера)
- Белимумаб (Бенлиста)
Главные преимущества биологически активных препаратов
- Быстрое действие — купируют воспаление и тормозят разрушение сустава после нескольких дней применения (по сравнению с 1-3 месяцами до явного клинического эффекта при обычной базисной терапии).
- Возможность комбинации с традиционными препаратами, ускорение и усиление их действия.
- Эффективность в ряде резистентных к традиционной терапии случаев (до 84%). Раннее начало лечения обеспечивает лучший результат. Комбинированная терапия биопрепаратов с метотрексатом (препаратом базисной терапии) эффективнее, чем лечение одним препаратом.
- Эффективность подтверждается клиническими, лабораторными и инструментальными методами:
- снижением уровня воспалительных показателей (СОЭ, СРБ), РФ (ревматоидного фактора);
- улучшением состояния хрящевой ткани по данным рентгенологических исследований – отсутствием новых эрозий, тенденцией к заживлению старых;
- повышением двигательной активности и качества жизни пациентов, сохранением их трудоспособности.
Недостатки биологической терапии
- Подавление иммунитета, повышение опасности инфекционных осложнений.
- Возможность развития аллергических реакций на сами препараты (чужой белок).
- Дорогое лечение.
Противопоказания к биотерапии:
- Наличие у пациента активного туберкулёза, гепатитов В и С, герпетической и ВИЧ- инфекции.
- Пневмония, бронхит, синусит, рожистое воспаление, инфекция мочевыводящих путей, дивертикулит, локальные инфекции, септический артрит, сепсис и т.д.
- Злокачественные новообразования.
Важно! Данные противопоказания (особенно инфекционные) актуальны исключительно в активный период болезни. После проведения эффективной антибактериальной или противовирусной терапии возможно применение биологических препаратов.
В лечении ревматоидного артрита новые генно-инженерные препараты дают надежду многим пациентам с упорным, резистентным (устойчивым) к обычной терапии течением болезни.
Наши врачи-ревматологи применяют самые современные схемы лечения ревматологических заболеваний. Все новейшие препараты, прошедшие необходимую проверку и доказавшие высокую эффективность, немедленно используются в нашей лечебной практике.
В МЦ «Столица» вы пройдёте лечение ревматологических заболеваний с применением самой современной фармакотерапии, инновационных технологий экстракоропоральной гемокоррекции. существенно улучшающих результаты терапии, физиотерапии, ортопедической помощи.
Лечение ревматоидного артрита биологическими препаратами
Генная инженерия при ревматоидном артрите – новое подспорье при лечении заболеваний аутоиммунной природы, направленное на восстановление иммунных функций организма.
Коварство заболевания состоит в том, что его причиной являются сбои иммунных процессов, которые крайне сложно поддаются прогнозу и лечению. В этом состоит отличие РА от иных схожих недугов – ревматизма, ревматического, травматического, инфекционного и других видов артрита. Поэтому лечить этот вид заболевания необходимо путем воздействия на иммунные процессы организма.
Терапия биопрепаратами еще не завоевала должной популярности в силу внушительной стоимости этого вида лекарств. Однако современная генная инженерия постоянно внедряет новые разработки и методы производства препаратов, для того чтобы сделать их доступными большему кругу людей.
О том, как лечить ревматоидный артрит стволовыми клетками – виды биопрепаратов, их преимущества и особенности – мы расскажем в этой статье.
Краткий обзор
Генно-инженерные биологические препараты (ГИПБ) разработаны на основе антител мышиной, человеческой, химерической или гуманизированной этиологии.
Это так называемые иммуноглобулины – искусственно синтезированные иммунные клетки. Попадая в организм человека, они подавляют и уничтожают клетки вирусов, патогенные бактерии и инфекции. Поэтому моноклональные препараты при ревматоидном артрите – действенный способ полностью устранить причину заболевания и вернуть пациенту радость жизни.
Препараты генной инженерии, используемые при ревматоидном артрите, производят в таком порядке:
- Искусственно повышают иммунитет лабораторным животным.
- Стимулируют у них производство иммунных агентов, подавляющих определенные генетические группы.
- Выделяют клеточные клоны, стимулирующие процесс заживления тканей организма самостоятельно.
В генно-инженерном производстве для получения моноклональных антител практикуется использование бактериофагов – вирусов, подавляющих рост определенных микроорганизмов, являющихся носителями генного материала.
Достоинства терапии
Моноклональные антитела при ревматоидном артрите, помогают устранить саму первопричину болезни. Кроме того, генная биотерапия способна избавить и от иных заболеваний аутоиммунной, онкологической, пульмонологической, дерматологической этиологии, нормализовать процесс адаптации трансплантированного органа.
Лечение ревматоидного артрита на основе генно-инженерных биодобавок способствует подавлению активности аутоиммунных клеток, которые отторгают и разрушают хрящевые ткани суставов. Такой терапевтический эффект тормозит прогрессирование разрушительного процесса и болезнь уходит.
Моноклональные тела при ревматоидном артрите показали большую эффективность как базисные медикаментозные средства, воздействующие на первопричину развития недуга – аутоиммунный сбой.
По отзывам врачей, лекарства на основе стволовых клеток помогают значительно улучшить состояние хрящевой и костной ткани самых разных суставов: коленного, голеностопного, кисти и т. д. при артрите аутоиммунного типа.
Разновидности
При генно-инженерной терапии РА могут применяться следующие виды лекарств:
- Производимые на основе антител мышей. Эти медикаменты (Инфликсимаб) считаются средствами 1 поколения, уже значительно устарели и применяются довольно редко.
- Лечебные средства гуманизированного типа, представляющие собой гибрид антител мышей и человеческих клеток с высоким уровнем взаимодействия.
- Биопрепараты на основе иммунных клеток человека – самые действенные и популярные в генной медицине. Их наименований очень много – Алемтузумаб, Рамуцирумаб, Элотузумаб, Трастузумаб, Блинатумомаб.
- Биологические лекарства от ревматоидного артрита, на четверть состоящие из мышиных антител (Ремикейд).
Прием лекарств
Биологическое лечение РА – процесс длительный. Лекарства генной инженерии предназначены для инфузионного введения. Лекарства вводят постепенно, строго регулируя дозировки и отслеживая реакцию организма.
До назначения лечебного курса доктора направляют пациента на лабораторное исследование внутрисуставной жидкости. Конкретный препарат, дозировку и длительность его применения выбирается исходя из результатов этого анализа.
Побочные эффекты
Учитывая силу воздействия средств генной биологии, при их применении следует точно убедиться в отсутствии противопоказаний. В основном, таковые находятся в прочной взаимосвязи с возможными побочными эффектами на фоне приема биопрепаратов.
В число самых частых побочек входят:
- Инфекционные процессы, в том числе такие тяжелые, как заражение крови, туберкулез.
- Недуги онкологической этиологии.
- Заболевания гематологического характера: полицитемия, анемия.
- Серьезные сердечные дисфункции.
- Новые аутоиммунные нарушения.
- Тяжелые аллергические проявления.
Как говорилось ранее, противопоказания к приему ГИПБ идентичны возможным побочным явлениям. Перед началом терапии пациенту предлагается пройти ряд исследований, чтобы исключить латентный туберкулез. Это такие, как рентгенография, диаскинтест, кожно-туберкулиновое исследование, анализ крови на квантиферон-тест.
Чаще всего ГИПБ рекомендуется принимать в сочетании с базисными средствами «Метотрексат», «Лефлуномид», «Сульфасалазин». Иногда средства генной инженерии назначаются в качестве монотерапевтических. Однако при их комбинации с иммунодепрессантами наблюдается более выраженный терапевтический эффект, что подтверждается данными рентгенографических исследований.
В качестве моносредства лучше всего зарекомендовал себя такой биопрепарат, как Тоцилизумаб.
Подводя итоги
Клетки моноклональных антител воздействуют на аутоиммунные возбудители ревматоидного артрита, блокируя их активность, препятствуя дальнейшему распространению недуга.
ГИБП при терапии РА устраняют патогенные комплексы из состава крови, предупреждая тем самым развитие повторных рецидивов заболевания.
Цена на эти группы препаратов, которая на порядок превышает средние показатели обусловлена сложностью и многоэтапностью их производства (10-20 тыс. руб.).
По мнению медицинских работников, лечиться генно-инженерными биологическими препаратами гораздо эффективнее в сравнении с традиционной методикой противоартритной терапии: НПВП, глюкокортикостероидами, физиотерапевтическим лечением.
Поэтому препараты генной инженерии считаются лучшим средством при терапии РА и иных сложноизлечимых заболеваний.
По отзывам докторов, назначавших лечение ГИПБ, стойкого выздоровления и длительной ремиссии удается достигнуть не более 60% от общего числа пациентов. Такой эффект связан с тем, что у остальных наблюдалась повышенная устойчивость (резистентность) к препаратам генной инженерии.
По окончании курса терапии моноклональными антителами часто наблюдается обострение состояния пациента. Это вызвано характером взаимодействия иммунных клеток с патогенными агентами и считается нормой.
По отзывам пациентов, генная инженерия – это элитарное средство борьбы с трудноизлечимым недугом, принципиально новый и эффективный вариант лечения.
Алина Евгеньевна, 45 лет, Рыбинск: «У нас в родне многие женщины, как пожилые, так и довольно молодые, долго и безуспешно лечатся от аутоиммунного артрита. Я тоже лет с 35 страдаю, каких только лекарств и методов не испробовала! И нестероиды, и кортикостероиды и лазерное лечение. На курорты, в самые лучшие санатории езжу, благо заработки позволяют, но нога все равно продолжает болеть. Поехала в очень известную частную клинику в Москве и там мне посоветовали принципиально новый выход – лечение препаратами генной инженерии на основе моноклональных антител.
Да, они дорогие – около 20 тысяч за упаковку, но я уже устала мучиться с коленом! Перед началом лечения пришлось пройти долгое обследование, сдать дорогие анализы, чтобы исключить рак, туберкулез, аллергию.
Затем мне длительным курсом делали эти уколы, пришлось соблюдать некоторые ограничения. Да и после курса было такое обострение, страшно вспомнить. Доктора говорят – это норма, иммунные клетки борются с возбудителями болезни. Но все получилось! После поездки в клинику прошло уже больше года, о болезни не вспоминаю. Просто чудо».
Статья написана по материалам сайтов: dislife.ru, osankasovet.ru, www.eg-online.ru, doctorchentsov.ru, medicinanog.ru.
»